|
Neutralisation
Bei der reagiert eine und eine zu Salz und Wasser.
Die Stoffemengen der () und der () sind nach der gleich groß.
Treffen die beiden Ionenarten H3O+ und OH- aufeinander, reagieren sie zu. Die Ionen aus den Lösungen neutralisieren sich also gegenseitig, infolgedessen wird die Reaktion als bezeichnet.
Die sreaktion ist eine zwischen und Hydroxid-Ionen.
Die Metallionen und die Säurerest-Ionen bleiben dabei unverändert.
Allgemeines Reaktionsschema: |
|
|
Säure + Base ---> Salz + Wasser |
|
|
Beispiel: : |
|
HCl + NaOH ---> NaCl + H2O |
Salzsäure + Natriumhydroxid ---> Natriumchlorid + Wasser |
|
| Beispiel: Zweiprotonige Säure: |
|
| Mg(OH)2 + 2HCl --> Mg2+ 2Cl- + 2H2O |
| Magnesium + Salzsäure --> Magnesiumchlorid + Wasser |
|
Allgemeine Ionengleichung der Neutralisation: |
 |
+ ---> H2O + H2O |
+ ---> Wasser |
Die ist eine exotherme Reaktion. Es wird Wärme abgegeben, diese heißt Neutralisationswärme.
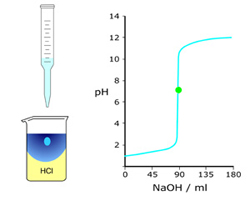
Die sreaktion wird in der chemischen Praxis eingesetzt, um mit einer bekannten Säurekonzentration
die unbekannte einer zu ermitteln. Dieses maßanalytische Verfahren kann auch umgekehrt angewandt
werden und wird als Säure-Base-Titration bezeichnet. |
 Zurück zu Indikatoren | Hot Potato
Zurück zu Indikatoren | Hot Potato