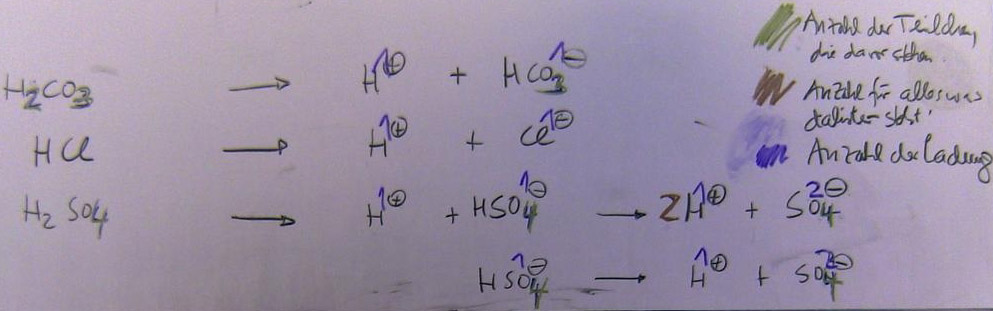Lexikon
A
Ampholyte:
Ampholte können sowohl Protonen aufnehmen als auch abgeben. Sie sind Protonenakzeptor als auch Protonendonator.
Anion:
Negativ geladenes Ion, entstanden durch Aufnahme eines oder mehrerer Elektronen aus der Elektronenpaarbindung.
Äquivalenzpunkt:
Punkt während einer Titration, bei dem äquivalente, sprich gleichwertige Mengen der Reaktanden zusammengegeben wurden.
Arrhenius, Svante:
stellte 1887 seine „chemische Theorie der Elektrolyte“ vor.

Arrhenius-Base:
Verbindung, die in Wasser OH ¯- Ionen bilden.
Arrhenius-Gleichung:
Beziehung zwischen Geschwindigkeitskonstanten, der Aktivierungsenergie und der Temperatur für eine chemische Reaktion.
Arrhenius-Neutralisation:
Reaktion zwischen H+- und OH ¯- Ionen unter Bildung von Wasser.
Arrhenius-Säure:
Verbindung, die in Wasser H+- Ionen bildet.
Atom:
Das kleinste Teilchen. Atome sind unteilbar.
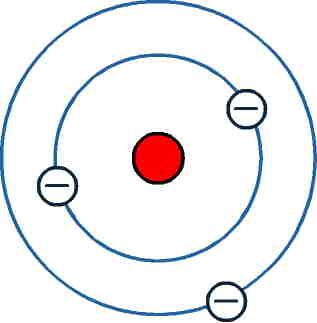
Atombausteine:
Protonen (p+) , Elektronen (e-) und Neutronen (n)
Atomkern:
Positiv geladenes Zentrum eines Atoms, in dem sich Protonen und Neutronen befindet.
Atommasse:
Masse eines Atoms, bezogen auf eine Skala, bei der die Masse des Atoms C 12u beträgt. Bei Elementen, die aus verschiedenen Isotopen bestehen, wird die mittlere Masse des Isotopengemisches angegeben.
Autoprotolyse des Wassers:
Nach Brønsted ist auch diese Reaktion eine Protolyse; eines der beiden Wassermoleküle reagiert als Protonendonator (Säure), ein anderes hingegen als Protonenakzeptor (Base). Da der Zerfall ohne äußeres Einwirken von selbst erfolgt, spricht man von einer Autoprotolyse des Wassers.

H2O + H2O  H3O+ + OH- H3O+ + OH-
B
Base:
Nach Arrhenius ein Stoff, der in wässriger Lösung OH ¯ - Ionen bildet. Nach Brønstedt ein Stoff, der H+ - Ionen anlagern kann.
Batteriesäure:
Schwefelsäure.
Blut:
Biochemische Reaktion. Im Körper ist es wichtig, dass der pH-Wert des Blutes konstant bleibt. pH-Wert = 7,4.
Brønsted, Johannes
stellte 1923 ein weiter gefasstes Konzept für die Säuren und Basen vor.

Brønsted-Base:
Substanz, die Protonen aufnehmen kann und Protonenakzeptor genannt werden kann.
Brønsted-Säure:
Substanz, die Protonen abgeben kann (Protonendonator).
C
Chemische Formel:
Formel zur Bezeichnung der Art und relativen Anzahl der Atome in einer Verbindung mit Hilfe von Elementsymbolen.
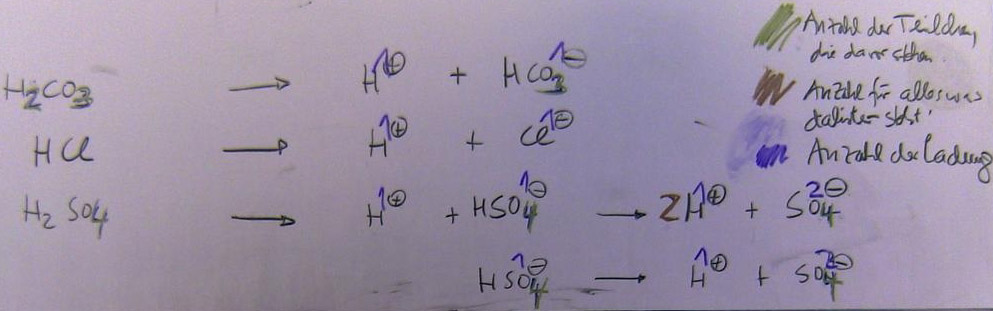

Chemische Konservierungsstoffe:
Chemische Konservierungsmittel sind Stoffe die Mikroorganismen töten oder zumindest ihre Entwicklung hemmen.
Chemische Reaktionsgleichung:
Wiedergabe einer chemischen Reaktion mit Formeln und Stoffmengen der beteiligten Substanzen.
Chemisches Gleichgewicht:
Chemischen Reaktion die im Gleichgewicht vorliegt, d.h. die Hinreaktion läuft gleich schnell wie die Rückreaktion ab.
D
Dipol-Dipol-Kräfte:
Anziehungskräfte zwischen polaren Molekülen aufgrund der Anziehung zwischen entgegengesetzten Polen. Bei Dipolen ist die Rede von polarisierten Atomen, zwei Atome mit unterschiedlicher Elektronegativität.
Dissoziationsenergie:
Energie, die für den Zerfall benötigt wird.
Doppelbindung:
Elektronenpaarbindung, die durch gemeinsame Elektronen zwischen zwei Atomen gebildet wird. Bei einer Zweifachbindung sind zwei gemeinsame Elektronenpaare vorhanden.
Dreifachbindung:
Elektronenpaarbindung, die durch gemeinsame Elektronen zwischen drei Atomen gebildet wird. Bei einer Dreifachbindung sind drei gemeinsame Elektronenpaare vorhanden.
E
Edelgase:
Elemente der 8. Gruppe des Periodensystems. Sie zeichnen sich durch besondere chemische Reaktionsträgheit aus. Sie können keine e ¯ aufnehmen.
Einfachbindung:
Elektronenpaarbindung, die durch gemeinsame Elektronen zwischen zwei Atomen gebildet wird. Bei einer Einfachbindung ist es ein gemeinsames Elektronenpaar vorhanden.
Einprotonige Säure:
Säure, die nur ein Proton pro Verbindung abgeben kann.
Elektrische Leitfähigkeit:
Maß für die Fähigkeit eines Stoffes, den elektrischen Strom zu leiten. Dies geht bei Leiter 1. Ordnung als Elektronenleitung und bei Leiter 2. Ordnung als Ionenleitung.
Elektron:
Subatomares Teilchen mit der Masse 0,00055 u und negativer Ladung e (Elementarladung). Masse trägt dort maßgeblich zur Atommasse bei.
Elektronegativität:
Ein Maß für die relative Fähigkeit eines Atoms, Elektronen eines anderen Atoms an sich zu ziehen.

Nimmt innerhalb der Periode von Minimum zu Maximum zu und
inner halb der Periode der Hauptgruppe von Minimum zu Maximum ab.
Element:
Stoff, der nicht weiter zerlegt werden kann.

Energie:
Die Fähigkeit, Arbeit zu leisten.
G
Gruppe:
Elemente mit gleicher chemischer Reaktion, die im Periodensystem in einer Spalte stehen.
H
Halbwertszeit:
Benötigte Zeit, bis bei einer Reaktion die Hälfte der Reaktanden verbraucht ist. Bei radioaktiven Substanzen: Zeit, die vergeht, bis die Hälfte der Probe zerfallen ist.
Hauptgruppen:
Elemente, bei denen die äußeren Elektronenwolken gefüllt werden müssen.
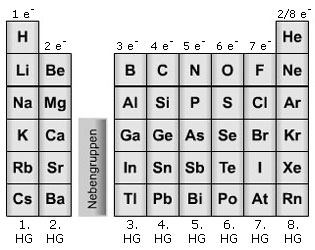
In dieser Abbildung sind die Hauptgruppen die Senkrechten
Hydration:
Umhüllung gelöster Teilchen durch Wasser-Moleküle aufgrund von anziehenden Kräften.
Hydronium - Ion:
Ion, das aus einem Proton und einem Wasser-Molekül gebildet wird, H3O+.

H+ + H2O  H3O+ H3O+
Hydroxid-Ion:
Das Hydroxidion ist ein negativ geladenes Ion das entsteht, wenn Basen mit Wasser reagieren. Seine chemische Formel lautet OH -.
I
Indikator:
Substanz, die bei einer Titration das Erreichen des Äquivalenzpunktes anzeigt. Ein Säure-Base Indikator hat verschiedene Farben bei verschiedenen pH-Werten. Indikatoren spielen eine wichtige Rolle bei der Säure-Base-Titration.

Ion:
Ein Teilchen, das aus einem oder mehreren Atomen besteht und eine elektrische Ladung trägt, die positiv oder negativ sein kann.
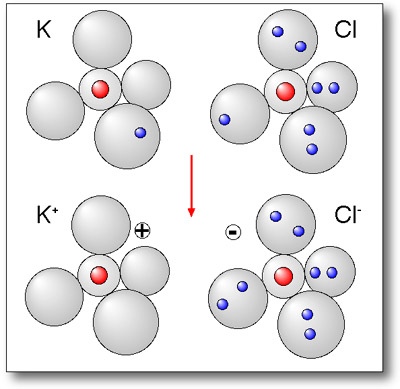
Ionenbindung:
Bindung die negative und positive Ionen zusammenhält und zu einem Ionenkristall führt. Sie kommt durch den Übergang von Elektronen von einer Atomsorte auf eine andere zustande.
Ionenprodukt des Wassers:
Produkt aus der H3O+ – Ionenkonzentration mit der OH ¯ - Ionenkonzentration in wässrigen Lösungen; bei 25 ° C:
c(H3O+) * c(OH¯) = Kw = 10 -7 mol/l * 10 -7 mol/l = 10 -14 mol/l .
Ionenverbindung:
Verbindung, die aus Kationen und Anionen aufgebaut ist und durch die elektro statische Anziehung zwischen ihnen zusammengehalten wird.
Isotope:
Atome des gleichen Elements und daher gleicher Ordnungszahl, aber unterschiedlicher Massen- und Neutronenzahl. Isotope haben gleiche Protonenzahlen aber unterschiedliche Neutronenzahlen.
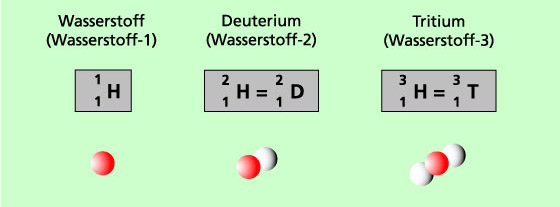
rot = Proton und weiß = Neutron
K
Kation:
Positiv geladenes Ion, entstanden durch Abgabe von Elektronen aus einem Atom.
Kohlenwasserstoff:
Verbindungen, die nur Kohlenstoff und Wasserstoff enthalten.

Konjugiertes oder korrespondierendes Säure-Base-Paar:
Brønsted-Säure-Base-Paar, das durch Abgabe bzw. Aufnahme eines Protons in Beziehung steht, z. B. NH4+ - Ion (Säure) und NH3 (Base).
Konzentration:
Menge eines gelösten Stoffes in einer gegebenen Menge einer Lösung.
L
Lauge:
Nach Arrhenius ein Stoff, der in wässriger Lösung OH ¯ - Ionen bildet. Nach Brønstedt ein Stoff, der H+ - Ionen anlagern kann.
Leitfähigkeit:
Die elektrische Leitfähigkeit von Lösungen ist ein Parameter für geöste, dissoziierte Stoffe. Die Größe der Leitfähigkeit hängt von der Konzentration und dem Dissoziationsgrad der Ionen sowie der Temperatur und der Wanderungsgeschwindigkeit ab. Über die Art der Ionen selbst kann eine Messung der Leitfähigkeit keine Aussage machen. Trotzdem kann man exakte Rückschlüsse von der Leitfähigkeit auf die Konzentration der gelösten Elektrolyte ziehen, wenn die Ionen - Zusammensetzung und die Äquivalentleitfähigkeit bekannt sind.
Lösung:
eine Lösung ist in der Chemie ein homogenes Gemisch, das aus einem oder mehreren gelösten Stoffen und einem Lösungsmittel besteht.
M
Masse:
Maß für die Menge von Materie.
Mehratomiges Ion:
Ein Molekül-Ion Ion, das aus mehreren Atomen besteht.
Mehrprotonige Säure:
Säure, die mehr als ein Proton pro Molekül abgeben kann.
Mol:
Stoffmenge, die genauso viel Teilchen enthält wie Atome in 12g von 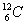 enthalten sind. 1 Mol = feste Anzahl von Teilchen, sprich 6,022 * 1023. enthalten sind. 1 Mol = feste Anzahl von Teilchen, sprich 6,022 * 1023.
Molare Masse:
Masse von einem Mol.
Molekül:
Teilchen, das aus mehreren aneinandergebundenen Atomen besteht.
Molekülmasse:
Masse eines Moleküls.
N
Nebengruppen:
Elemente, bei denen sowohl die inneren als auch die äußeren Elektronenwolken e- - Wolken noch nicht ganz gefüllt sind.
Neutralisation:
Reaktion zwischen einer Säure und einer Base zu Wasser und Salz.
Neutron:
Baustein des Atomkern. Teilchen ohne elektrische Ladung, mit Masse 1,0087 u.
Nucleon:
Ist im Kernbaustein. Ein Proton oder ein Neutron.
O
Oxidation:
Teil einer Reaktion, bei der es zur Abgabe von Elektronen, d.h. zur Erhöhung der Oxidationszahl kommt.
P
Periode:
Zeile des Periodensystems der Elemente.
Periodensystem:
Tabelle der chemischen Elemente, geordnet nach ihrer Ordnungszahl und nach ihren chemischen Eigenschaften.
pH-Wert:
Der negative dekadische Logarithmus der H+– Ionenkonzentration: pH = - log c[H+].
Formel zur Berechnung des pH-Wertes:
pH = - log c[H+ ] = - log c[H3O+ ]
pH = - log c[H3O+ ] mol/l
pH = 14 – pOH
Beispiel pH- Wertberechnung:

pOH-Wert:
Der negative dekadische Logarithmus der OH ¯– Ionenkonzentration.
Formel zur Berechnung des pOH-Wertes:
pOH= - log c [ OH- ]
pOH= 14 - pH
Produkte:
Substanzen, die bei einer chemischen Reaktion entsteht.
Protolyse:
Unter Protolyse versteht man den Übergang von Protonen von einer Substanz auf eine andere.
Proton:
Kernbaustein und Masse 1,0073u mit positiver Ladung. H+ werden auch als Protonen bezeichnet.
Protonigkeit:
Eine Verbing bezeichnet man als einprotonige Säure, wenn es insgesamt nur ein Proton - gemeint ist das Wasserstoff-Ion H +- an eine Base abgeben kann. Wenn es insgesamt zwei abgeben kann, ist es zweiprotonige Säure und wenn es drei abgeben kann, ist es eine dreiprotonige Säure. H+-Teilchen werden auch als Protonen bezeichnet.
R
Reaktionsernergie:
Gesamtenergie, die bei einer chemischen Reaktion aufgenommen oder angegeben wird.
S
Saurer Regen:
Saurer Regen besteht aus Schwefeldioxid (SO2 ) und Sticksoffoxide, die bei der Verbrennung von Öl und Kohle entstehen. Diese giftigen Stoffe gelangen in die Atmosphäre und reagieren mit schwebenden Wassertröpfchen zu Säure. Bei einem pH-Wert der < 5,6 ist, spricht man vom Sauren Regen.
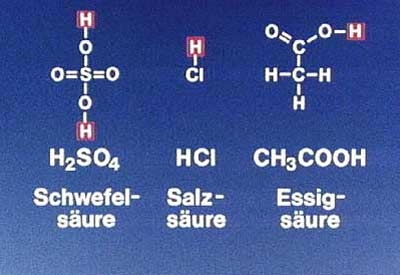
Säure:
Nach Arrhenius, eine Wasserstoff – Verbindung, die in wässriger Lösung unter Abgabe von H+ - Ionen und Bildung von H3O+ - Ionen dissoziiert. Nach Brønstedt eine Verbindung, die H+ - Ionen abgeben kann. Die H+ - Ionen bezeichnet man auch als Oxoniumionen. Säuren sind also Protonendonator.
Seife:
Seifen sind Salze schwacher Carbonsäuren und starken Basen, so dass sie in wässriger Lösung alkalisch reagieren.
Starke Säuren und Basen:
Säuren und Basen, die in wässriger Lösung vollständig dissoziieren.
Stoffmengenkonzentration:
Konzentrationsangabe einer Lösung als Stoffmenge gelöster Stoff pro Volumen Lösung (mol/l).
Strukturformel:
Formel, in der jedes vorhandene Atom eines Moleküls einzeln bezeichnet ist und in der die miteinander verbundenen Atome durch Bindungsstriche angezeigt sind.
T
Titration:
Vorgang, bei dem eine Lösung bekannter Konzentration zu einer zu bestimmenden Lösung gegeben wird, um deren Konzentration zu ermitteln.
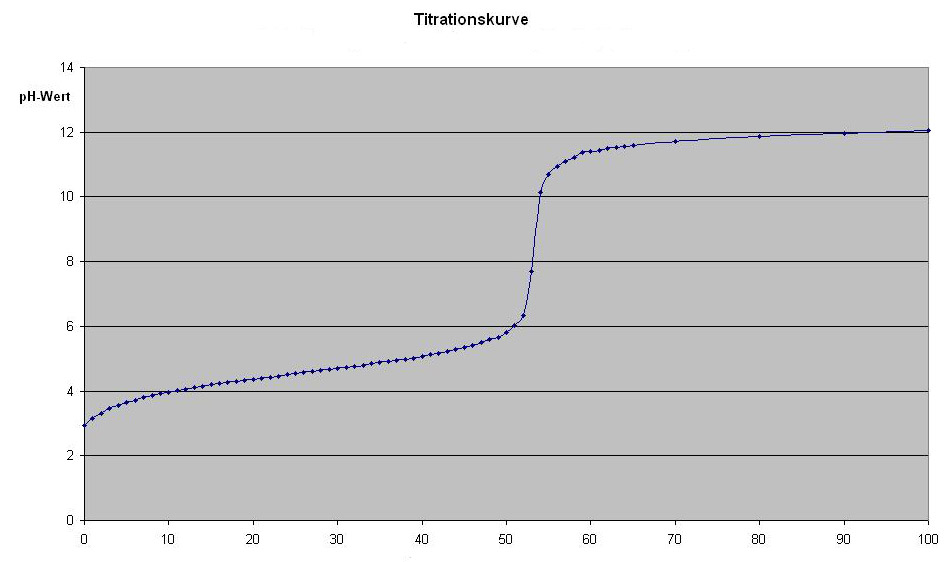
Titrationskurve:
Graph zur Darstellung des pH-Werts als Funktion der zugegebenen Reagenzmenge im Verlaufe der Reaktion.
V
Verbindung:
Reiner Stoff, der aus mehreren Elementen in festgelegtem Mengenverhältnis aufgebaut ist.

Ethanol = Alkohol
|
 Zurück
Zurück