Polarisierung Zwischen zwei unterschiedlichen Atomen, deren Elektronegativitätsdifferenz (/\EN) grundsätzlich kleiner 1,7 ist, kann es keine reine Elektronenpaarbindung mehr geben. Das Atom des stärker elektronegativen Elementes zieht das gemeinsame Elektronpaar stärker an als das Atom des schwächer elektronegativen Elementes. Dadurch entsteht eine polarisierte Elektronenpaarbindung. Beispiel: Chloratome sind erheblich elektronegativer als Wasserstoffatome. Im Chlorwasserstoffmolekül (HCl) wird daher das gemeinsame Elektronenpaar vom Chloratom stärker angezogen als vom Wasserstoffatom (H): 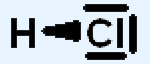
Erläuterung:
|
 Zurück zur Umrechnung | Weiter zu Hot Potato
Zurück zur Umrechnung | Weiter zu Hot Potato 