
Periodensystem
Periodensystem
Bei dem abgebildeten Elektronenwolkenmodell sind folgende Annahmen gemacht:
unbesetzte Elektronenwolken sind grau
halbbesetzte Elektronenwolken sind hellblau
vollbesetzte Elektronenwolken sind dunkelblau
vollbesetzte Elektronenschalen sind marineblau
der Atomkern ist ein schwarzer Punkt
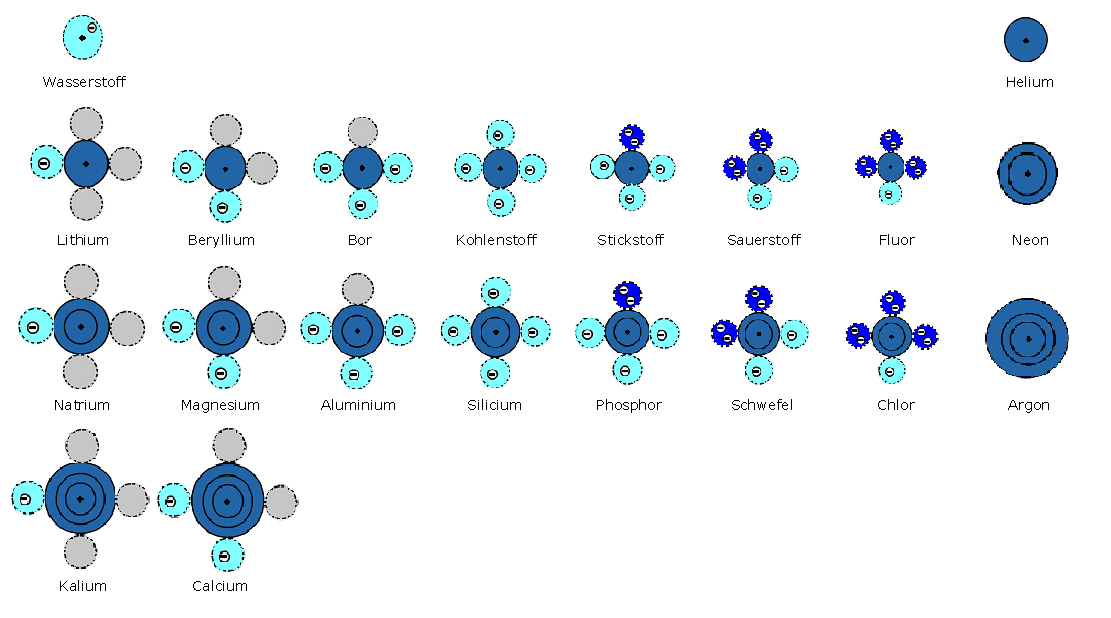
Abbildung der ersten 20 Elemente nach dem Elektronenwolkenmodell.
Regeln für die Aufstellung der Zeichnung eines Atoms nach dem Elektronenwolkenmodell EWM bei Angabe der Symbolschreibweise:
Atomkerne werden als Punkte im Zentrum gezeichnet
(Man kann nicht die Anzahl der Protonen entnehmen)
Schalen werden von innen nach außen besetzt
Vollbesetzte Schalen werden als volle Kreise gezeichnet
Wenn die römische Zahl ungleich VIII ist, ergibt sich die Anzahl der vollbesetzten Schalen aus der aktuelle Periode minus 1
(Die erste Schale kann nur 2 Elektronen aufnehmen)
Wenn die arabische Zahl größer als eins ist, gilt es vier Wolken zu malen
Wolken werden als gestrichelte Kreise gezeichnet
Teilbesetzte Schalen werden als vier EW gezeichnet
(Ausnahme erste Schale = eine EW)
Die römische Zahl oder Hauptgruppennummer genannt gibt die Anzahl der Elektronen
auf der äußeren Schale an
Jede EW kann maximal zwei Elektronen aufnehmen
EW einer Schale werden erst einfach dann doppelt besetzt
Atomradius
Der Atomradius ist der Abstand zwischen dem Atomkern und den Elektronen in der äußersten Elektronenschale der Elektronenhülle eines Atoms.
Innerhalb einer Periode des Periodensystems der Elemente nehmen die Atomradien von links nach rechts ab.
Mit steigender Zahl der Protonen innerhalb einer Periode werden die Elektronen stärker angezogen. Der Atomradius wird dadurch kleiner.
Innerhalb einer Hauptgruppe des Periodensystems der Elemente nehmen die Atomradien
von oben nach unten zu.
Innerhalb der Hauptgruppe nimmt die Anzahl der Schalen von oben nach unten zu. Mit steigender Schalenzahl wird das Atom größer.
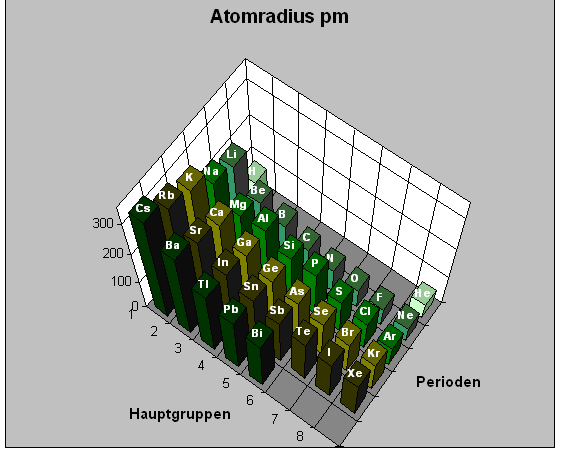
Die waagerechte Achse stellt die Hauptgruppennummer dar. Die Tiefenachse gibt die Perioden (Elektronenschalen) und die Höhenachse den Atomradius an.
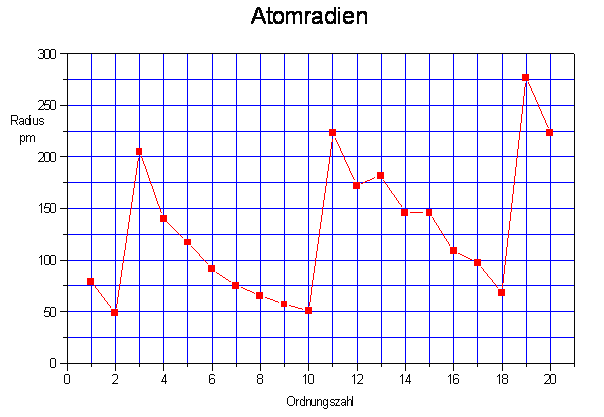
Die waagerechte Achse stellt die Ordnungszahl dar. Die Höhenachse gibt den den Atomradius an.
Ionisierungsenergie
Die Ionisierungsenergie ist die Energie, die benötigt wird, um ein Atom (oder Molekül) zu ionisieren, d. h. um ein Elektron aus dem Atom oder Molekül zu entfernen.
Nach der Ionisierung hat ein vorher elektrisch neutrales Atom eine positive elektrische Ladung. Man spricht von einem positiv ionisierten Atom oder einem Kation. Aus einem Natriumatom Na entsteht ein Natriumkation Na+.
Innerhalb einer Periode des Periodensystems der Elemente nimmt die Ionisierungsenergie von links nach rechts zu.
Die Ionisierungsenergie wird größer je stärker die Elektronen im Atom gebunden sind. Die Ionisierungsenergie ist innerhalb einer Periode größer je kleiner der Atomradius ist.
Innerhalb einer Hauptgruppe des Periodensystems der Elemente nimmt die Ionisierungsenergie von oben nach unten ab.
Je größer ein Atom innerhalb einer Hauptgruppe ist, desto weniger Energie wird zur Ionisierung benötigt.
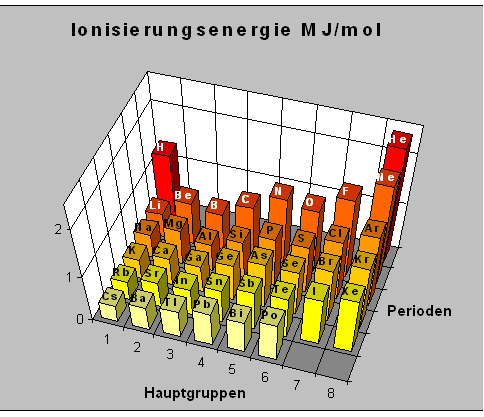
Die waagerechte Achse stellt die Hauptgruppennummer dar. Die Tiefenachse gibt die Perioden (Elektronenschalen) und die Höhenachse die Ionisierungsenergie an.
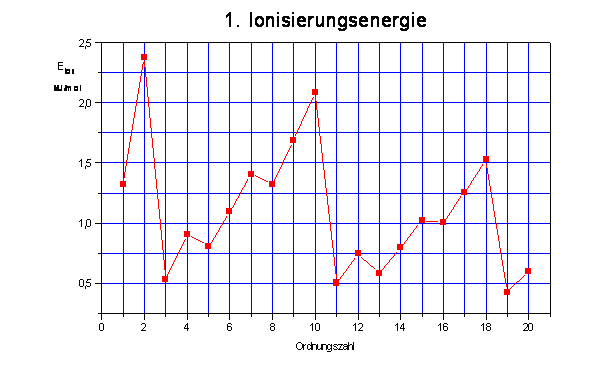
Die waagerechte Achse stellt die Ordnungszahl dar. Die Höhenachse gibt die Ionisierungsenergie an.
Elektronegativität
Die Elektronegativität ist ein relatives Maß für die Fähigkeit eines Atoms ein weiteres Elektron aufzunehmen (zu binden).
Innerhalb einer Periode des Periodensystems der Elemente nimmt die Elektronegativität von links nach rechts zu. Innerhalb einer Gruppe des Periodensystems der Elemente nimmt die Elektronegativität von oben nach unten ab.
Die Anziehungskraft eines Atomkerns auf weitere Elektronen hängt im Wesentlichen von zwei Faktoren ab:
der Anzahl der Protonen des Kerns
Innerhalb einer Periode steigt die Anziehungskraft auf die Elektronen mit steigender Protonenzahl von links nach rechts. Hinzukommende Elektronen werden ebenfalls stärker angezogen. Innerhalb der Periode steigt die Elektronegativität von links nach rechts.
Es gibt Ausnahmen. Welche?
der Entfernung der Elektronen vom Atomkern
Innerhalb einer Hauptgruppe entfernen sich die Elektronen mit zunehmender Schalenzahl vom Kern. Mit größerem Abstand werden sie weniger stark vom Kern angezogen. Je stärker ein Kern die äußeren Elektronen anzieht, desto stärker zieht er auch hinzukommende Elekrtonen an. Die Elektronegativität innerhalb einer Hauptgruppe steigt von unten nach oben.
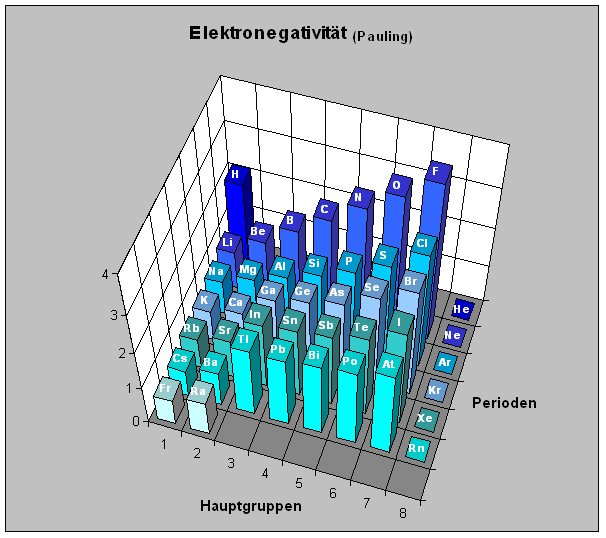
Die waagerechte Achse stellt die Hauptgruppennummer dar. Die Tiefenachse gibt die Perioden (Elektronenschalen) und die Höhenachse die Elektronegativität an.
Aufgabe:
Warum nimmt der Atomradius in der Periode von rechts nach links zu?
Warum nimmt der Atomradius in der Hauptgruppe von oben nach unten zu?
Warum nimmt die Ionisierungsenergie innerhalb der Periode von links nach rechts zu?
Warum fällt die Ionisierungsenergie von ... ?
Warum nimmt die Elektronegativität innerhalb der Hauptgruppe von oben nach unten ab?
Warum ist die Elektronegativität aller Elemente der 8. Hauptgruppe = 0?

E-Mail an: chemiekoenig(at)gmail(dot)com






