Elektronenpaarbindung / Atombindung / kovalente BindungElektronenpaarbindung - Orbitalmodell Bildung eines Wasserstoffmoleküls.
Wechselwirkung gleichartiger Atome:
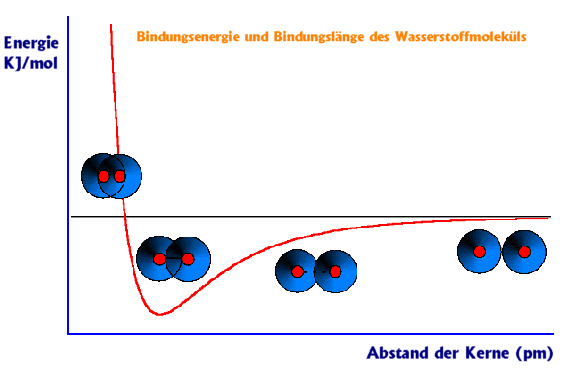
Die Bildung eines zweiatomigen Moleküls am Beispiel des Wasserstoffmoleküls H2. Wasserstoff ist ein zweiatomiges Molekül. Es ist aus zwei Wasserstoff-Atomkernen und einer sie umgebenden Elektronenwolke aufgebaut, die mit zwei Elektronen besetzt ist.
Wie das Wasserstoffmolekül zustande kommt:
Zwei Wasserstoffatome nähern sich. Der Kern des einen Atoms zieht das Elektron des anderen Atoms an und umgekehrt. Dabei durchdringen sich die beiden Elektronenwolken und eine einzige, beide Atomkerne umgebende Elektronenwolke entsteht, die mit zwei Elektronen besetzt ist. In dieser Elektronenwolke halten sich die Elektronen mit hoher Wahrscheinlichkeit zwischen den beiden Atomkernen auf. Dadurch entsteht eine Bindung zwischen den Atomen. Die Energie eines Moleküls ist abhängig vom Abstand der Atomkerne.
Die dargestellte Kurve verdeutlicht, wie eine Bindung entsteht. Sie ist typisch für zweiatomige Moleküle, zum Beispiel für das H2-Molekül. Wir wollen der Kurve von rechts nach links mit einem sich verringerndem Abstand folgen.
E-Mail an: chemiekoenig(at)gmail(dot)com
|